Pimobendan (P1): Sự co cơ và tác động của pimobendan

Pimobendan là gì?
Pimobendan là dẫn xuất của benzimidazole-pyridazinone với khả năng tác động lên hệ tim mạch. Hoạt chất này đã được nghiên cứu trên người và nhiều loại động vật từ cách đây khoảng 40 năm, và hiện vẫn tiếp tục được các nhà nghiên cứu mở rộng phạm vi ứng dụng trên các loài khác song song với việc sử dụng thương mại trên các loài đã được cấp phép. Trong lĩnh vực thú y, từ năm 2000, pimobendan đã được cấp phép sử dụng để điều trị tình trạng suy tim cũng như một số bệnh tim mạch trên chó, và hiện đang là một trong các loại thuốc luôn có sẵn tại các cơ sở thú y trên thế giới.
Sự co cơ
Ion canxi (Ca++) tích trữ chủ yếu trong lưới cơ tương (sarcoplasmic reticulum) của tế bào cơ tim đóng vai trò quan trọng trong quá trình co cơ. Khi xung điện truyền đến cơ tim và gây khử cực, một lượng nhỏ canxi ngoại bào được đưa vào trong tế bào cơ tim qua các kênh canxi type L và kênh trao đổi natri-canxi, kích thích thụ thể ryanodine 2 của lưới cơ tương và gây ra sự giải phóng canxi ồ ạt từ lưới cơ tương vào dịch nội bào. Canxi nội bào đến và gắn với troponin C trong phức hợp troponin gắn trên sợi tropomyosin, làm sợi tropomyosin dịch chuyển và bộc lộ các điểm neo trên sợi actin, tạo điều kiện cho chu trình nối cầu (cross-bridge cycle) giữa đầu myosin và sợi actin được diễn ra, dẫn đến sự co tơ cơ (sarcomere) mà chúng ta thường thấy ở thì tâm thu (khi tất cả các tơ cơ được co cùng lúc). Ngoài ra, giữa nồng độ canxi giải phóng vào dịch nội bào và lực co tạo ra cũng có mối liên hệ, nghĩa là dưới ngưỡng nồng độ canxi nhất định sẽ không gây ra sự co cơ, nhưng bắt đầu từ trên ngưỡng, lực co sẽ được tạo ra và tăng dần cho đến khi đạt đến mức bão hoà (không thể tăng thêm lực dù nồng độ canxi có tăng). Một số nghiên cứu cho thấy độ nhạy canxi của troponin C có thể thay đổi, trong đó với cùng một lượng canxi lực co có thể mạnh hơn (tăng độ nhạy) hay yếu hơn (giảm độ nhạy). Ngay sau quá trình co cơ (tâm thu), canxi tách khỏi troponin C và được chuyển ra khỏi dịch nội bào chủ yếu qua con đường tái hấp thu vào lưới cơ tương bằng bơm SERCA2a (sarco/endoplasmic reticulum ATPase) để dành cho lần co cơ tiếp theo, làm ngưng chu trình nối cầu và tơ cơ được nghỉ ngơi trong thì tâm trương.
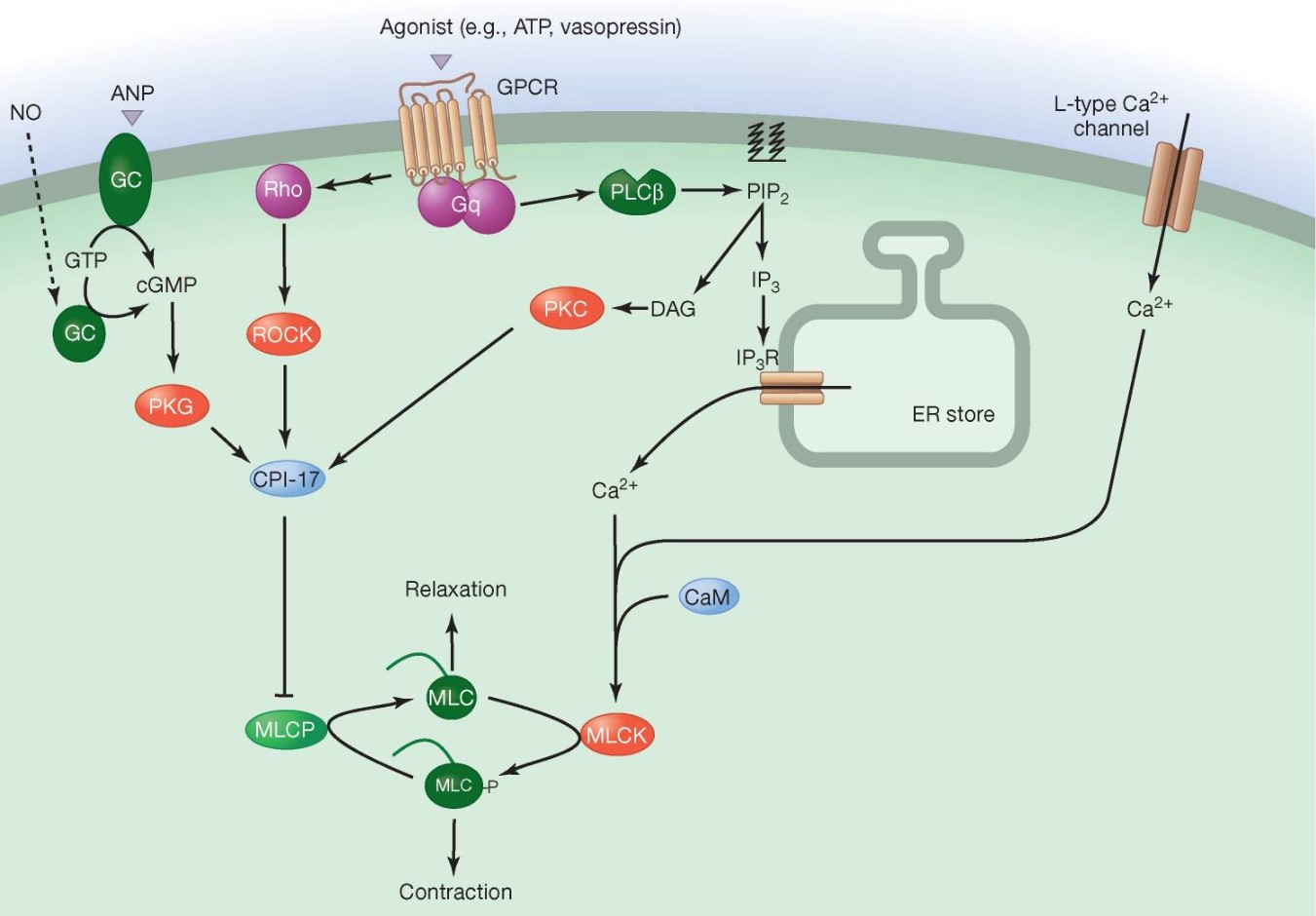
Ngoài xung điện, các catecholamines được tiết ra từ phản ứng thần kinh giao cảm (sympathetic nervous response) của cơ chế bù trừ như adrenaline và noradrenaline khi gắn với thụ thể beta-1 adrenergic trên màng tế bào cũng điều tiết sự giải phóng canxi vào dịch nội bào, khởi đầu bằng việc kích hoạt enzyme AC (adenylyl cyclase). Enzyme AC sau đó chuyển hoá ATP (adenosine monophosphate) thành cAMP (cyclic adenosine monophosphate), và cAMP tiếp tục kích hoạt enzyme PKA (protein kinase A). PKA làm tăng khả năng co bóp của tim bằng việc giải phóng nhiều canxi hơn vào dịch nội bào thông qua phosphoryl hoá kênh canxi type L và thụ thể ryanodine 2 (nhưng bị giới hạn do giảm độ nhạy canxi), và tăng nhịp tim thông qua phosphoryl hoá troponin I (trong phức hợp troponin) làm tăng tốc độ canxi tách khỏi troponin C và phosphoryl hoá phospholamban (protein ức chế bơm SERCA) giúp đẩy nhanh và nhiều canxi vào lại lưới cơ tương để sẵn sàng cho lần giải phóng tiếp theo. Lượng cAMP nội bào được điều tiết bởi enzyme PDE (phosphodiesterase), trong đó PDE phân giải cAMP thành 5’AMP.
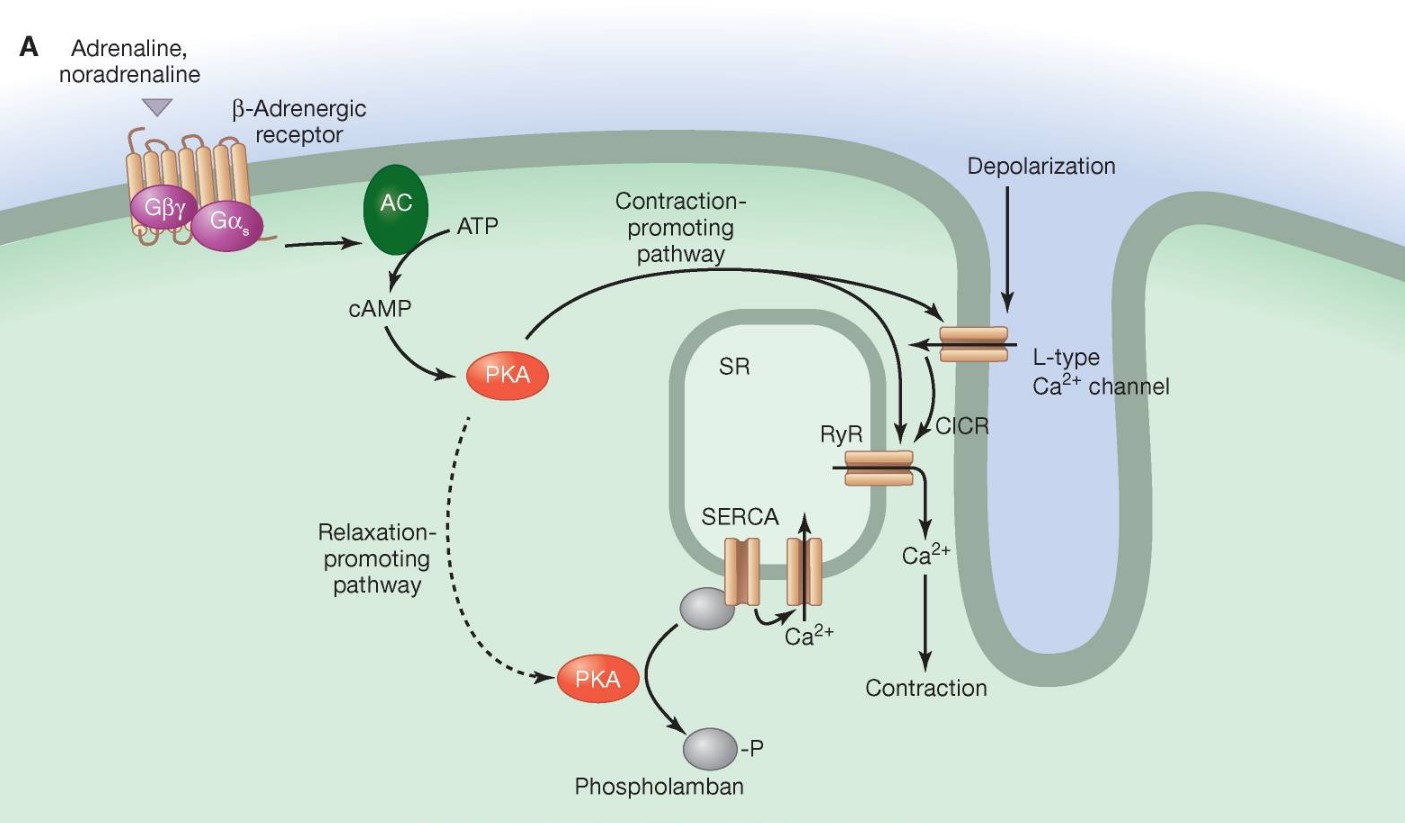
Tại tế bào cơ trơn của thành mạch máu, sự co cơ lại diễn ra theo cơ chế khác do không có phức hợp troponin. Canxi được vận chuyển vào trong dịch nội bào qua kênh canxi và lưới cơ tương, sau đó đến và gắn vào protein calmodulin. Phức hợp canxi-calmodulin tiếp tục đến gắn vào và kích hoạt enzyme MLCK (myosin light-chain kinase). Enzyme MLCK sau đó phosphoryl hoá đầu myosin tại MLC (myosin light-chain) và kích hoạt cầu nối giữa actin và myosin, tạo thành sự co cơ bằng chu trình nối cầu. Khác với tế bào cơ tim nơi có thụ thể beta-1 adrenergic phân bố, trên tế bào cơ trơn, thụ thể beta là loại beta-2 adrenergic. Adrenaline gắn lên các thụ thể này lại có tác dụng làm giãn thành mạch. Cơ chế tạo thành cAMP khi thụ thể được kích hoạt tương tự như trên tế bào cơ tim. Tuy nhiên, cAMP ở tế bào cơ trơn, thông qua enzyme PKA, lại phosphoryl hoá MLCK và làm giảm ái lực của enzyme này đối với phức hợp canxi-calmodulin, do đó ngăn chặn sự tương tác giữa actin và myosin, tạo thành hiệu ứng giãn mạch. cAMP trong tế bào cơ trơn được điều hoà bởi enzyme PDE3 (phosphodiesterase III), trong đó enzyme này phân giải cAMP thành 5’AMP.
Tác động của pimobendan lên hệ tim mạch
Pimobendan có 2 tác động chính lên hệ tim mạch, bao gồm làm tăng sức co bóp của tim (inotrope) và làm giãn thành mạch (vasodilation), nên hoạt chất này còn được gọi là “inodilator” hay “thuốc cường tim”. Đối với tác động lên sức co bóp của tim, pimobendan tăng độ nhạy của troponin C với canxi, giúp cơ tim co bóp mạnh hơn với lượng canxi ít hơn. Đối với tác động lên thành mạch, pimobendan đóng vai trò ức chế enzyme PDE3, từ đó giữ cho lượng cAMP trong tế bào cơ trơn luôn cao, tạo thành hiệu ứng giãn mạch. Việc ức chế enzyme PDE3 cũng giữ cho lượng cAMP trong tế bào cơ tim cao, làm tăng nhịp tim và khả năng co bóp. Tuy nhiên, ở những thú mắc bệnh suy tim, hệ beta-adrenergic ở tim bị giảm hoạt động, do đó PDE3 không có tác dụng đáng kể lên sự co bóp của tim.
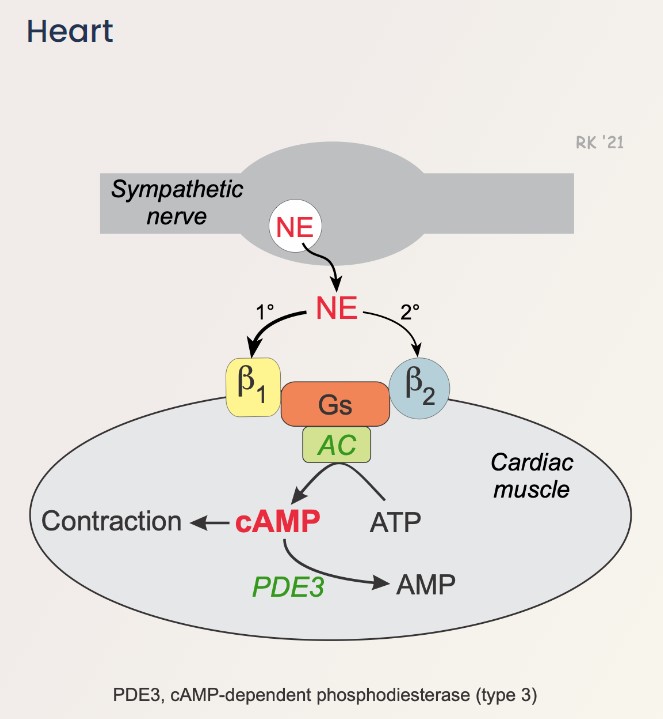
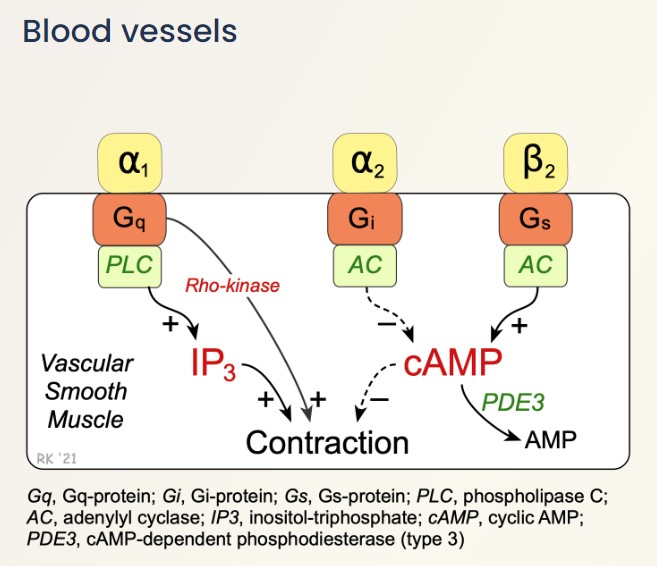
Tác động của enzyme phosphodiesterase III lên sự co và giãn của cơ tim và cơ thành mạch
Tài liệu tham khảo:
Klabunde, R. (2011). Cardiovascular physiology concepts. Lippincott Williams & Wilkins.
Kuo, I. Y., & Ehrlich, B. E. (2015). Signaling in muscle contraction. Cold Spring Harbor perspectives in biology, 7(2), a006023.
Lee, J. A. (1990). Calcium sensitizers. A new approach to increasing the strength of the heart. Br Med J, 300, 511-522.
MacLennan, D. H., & Kranias, E. G. (2003). Phospholamban: a crucial regulator of cardiac contractility. Nature reviews Molecular cell biology, 4(7), 566-577.
Nelson, R. W., & Couto, C. G. (2019). Small Animal Internal Medicine-E-Book: Small Animal Internal Medicine-E-Book. Elsevier Health Sciences.
https://en.wikipedia.org/wiki/Muscle_contraction#Mechanisms_of_smooth_muscle_contraction
Thuốc cường tim – P1
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4315934
Phạm Quốc Anh Minh